El suero hiperinmune desarrollado por investigadores de la UNSAM y la empresa Inmunova fue aprobado para ensayos clínicos en 242 pacientes que estén cursando el Covid-19.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó el ensayo clínico del suero hiperinmune desarrollado por científicos de la UNSAM y la empresa Inmunova.
A través de una disposición publicada el 24 de julio, el organismo autoriza “a realizar el estudio clínico denominado: Estudio fase 2/3, adaptativo, randomizado, controlado, doble ciego para estudiar la farmacocinética, la eficacia y la seguridad del suero equino hiperinmune en pacientes adultos con enfermedad moderada a severa confirmada SARS-CoV-2”.
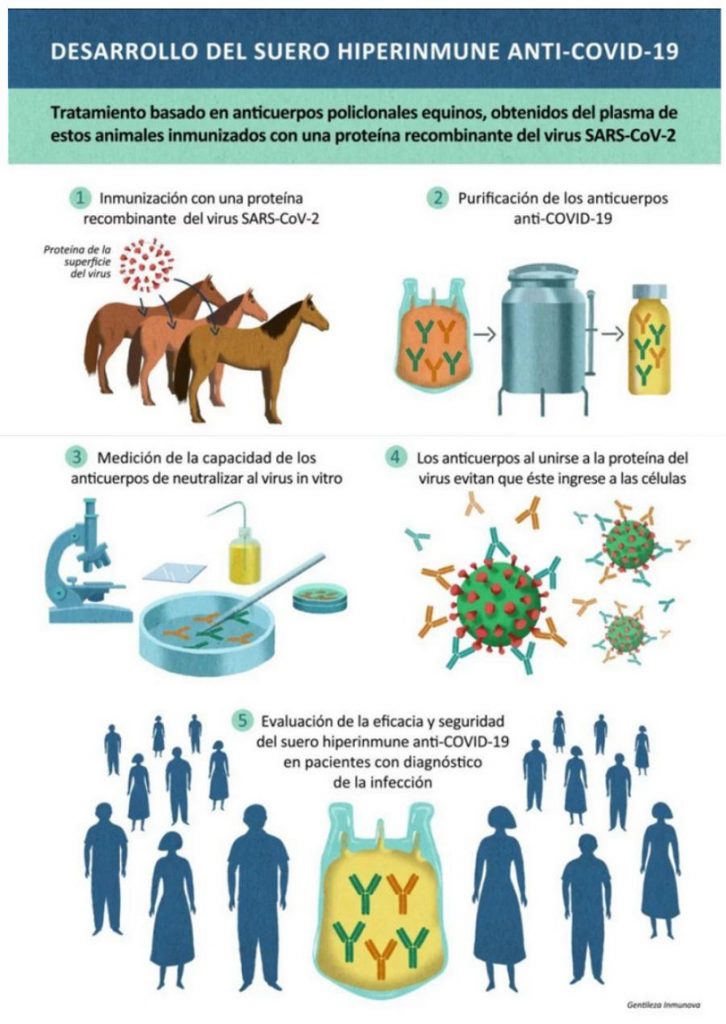
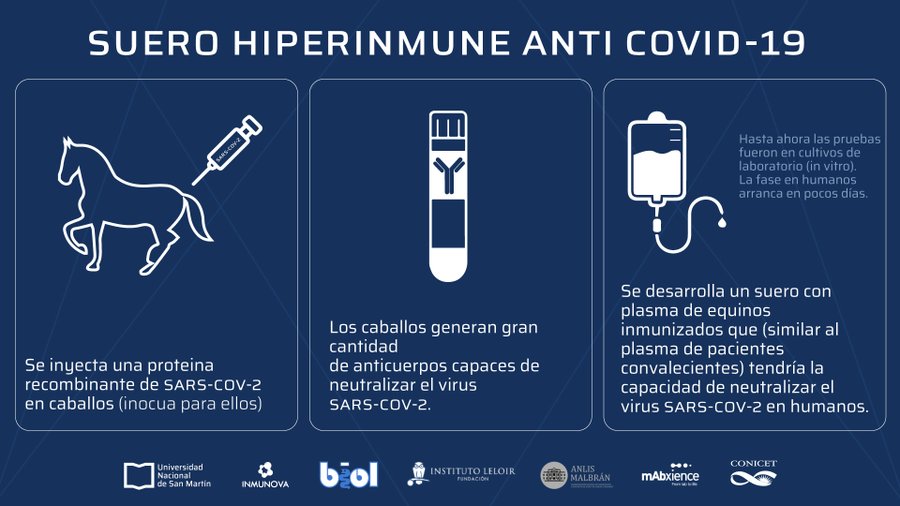
La ANMAT autorizó a que los ensayos clínicos con el suero equino se realicen en varios sanatorios del AMBA. El suero, que ya demostró que es capaz de neutralizar al virus en pruebas de laboratorio, es un tratamiento para pacientes con diagnóstico de la infección, a ser administrado en las primeras etapas de la enfermedad.
El suero hiperinmune logró desarrollarse gracias a una articulación pública-privada entre el laboratorio Inmunova, la UNSAM, el Instituto Biológico Argentino (BIOL), la Fundación Instituto Leloir (FIL), mAbxience, el CONICET y ANLIS Malbrán. Es un tratamiento que persigue la inmunización pasiva y que consiste en administrar anticuerpos a los pacientes contra el agente infeccioso, produciendo su bloqueo y evitando que se propague.
En el desarrollo del suero se utilizó como antígeno una proteína recombinante del virus SARS-CoV-2. Esa proteína se inyectó en caballos, para obtener anticuerpos policlonales. El suero producido contiene gran cantidad de estos anticuerpos con capacidad de impedir que el virus ingrese a las células y se multiplique.
Como actúa
“El suero equino tiene una capacidad neutralizante de 20 a 100 veces mayor que el promedio del plasma de convalecientes. La capacidad de neutralizantes es mayor, se los puede producir en gran cantidad por los volúmenes que se pueden obtener y se puede escalar para producir una cantidad muy importante, lo que permitiría utilizar estos anticuerpos en etapas más tempranas de la enfermedad”, explicó Fernando Goldbaum, director del Centro de Rediseño e Ingeniería de Proteínas del Instituto de Investigaciones Biotecnológicas de la UNSAM y socio fundador de la empresa biotecnológica INMUNOVA.
Como se hará
El estudio clínico comenzará la semana próxima en el Sanatorio Güemes, en el Hospital General de Agudos “Dr. Ignacio Pirovano”, ambos de CABA, en el Hospital Cuenca Alta – SAMIC de Cañuelas y en el Instituto Médico Platense de La Plata.
Próximamente iniciará en más de diez hospitales y clínicas de obras sociales del área metropolitana de Buenos Aires y La Plata. Incluye la participación voluntaria de 242 pacientes adultos con enfermedad moderada a severa causada por la infección del SARS-CoV-2 confirmada por PCR, dentro de los diez días del inicio de síntomas y que requieren hospitalización.