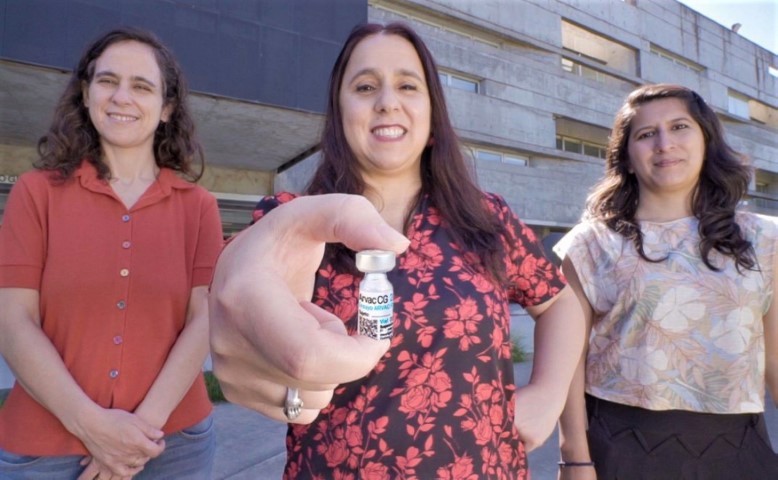- Se evaluará la seguridad, tolerabilidad e inmunogenicidad de la vacuna “ARVAC Cecilia Grierson”.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) autorizó el inicio de los estudios de Fases II y III para evaluar la seguridad, tolerabilidad e inmunogenicidad de la vacuna nacional “ARVAC Cecilia Grierson” desarrollada en conjunto por el CONICET, la Universidad Nacional de San Martín (UNSAM) y el Laboratorio Pablo Cassará.
El ministro de Ciencia, Tecnología e Innovación, Daniel Filmus, celebró “el esfuerzo de nuestros científicos, la articulación entre distintos actores públicos y privados, y el trabajo conjunto con el Ministerio de Salud, que permite seguir adelante con este proyecto necesario para la salud de los argentinos y para la soberanía sanitaria. Es la primera vez que se lleva adelante en el país estudios de Fase II y III para una vacuna de desarrollo nacional.”
“Contar con una vacuna de producción nacional contra COVID-19, desarrollada por investigadoras e investigadores argentinos, es una muestra concreta de lo que podemos lograr cuando el sector público y el privado aunamos esfuerzos y trabajamos en conjunto”, consideró su par de Salud de la Nación, Carla Vizzotti, quien destacó además el impulso otorgado por el Presidente a esta iniciativa.
Tras la aprobación recibida por ANMAT, la vacuna “ARVAC Cecilia Grierson” (ARVAC CG) está en condiciones de avanzar con los estudios clínicos de Fase II y III, que serán realizados en voluntarios adultos previamente vacunados contra el virus SARS-CoV-2.
La búsqueda de esta población se orienta a personas que ya hayan cumplido 18 años de edad o más, que se encuentren sanos y que hayan recibido dos dosis del esquema primario de la vacuna contra COVID-19, a los que se les aplicará el esquema de refuerzo de la vacuna en estudio. Los periodos interdosis serán los recomendados por el Ministerio de Salud de la Nación en los esquemas de vacunación publicados.
Cabe destacar que, a partir de los resultados parciales de la Fase I, se obtuvo información de seguridad preliminar que demostró que la vacuna “ARVAC Cecilia Grierson” es segura y muy inmunogénica. A su vez, se comprobó que una dosis de refuerzo incrementa hasta 30 veces los anticuerpos neutralizantes contra las variantes del virus Ómicron y Gamma.
Pensada para dosis de refuerzo en personas ya inmunizadas, la vacuna “ARVAC Cecilia Grierson” se basa en la tecnología de proteínas recombinantes, una tecnología segura que ya se aplica en las vacunas contra la Hepatitis B en niños recién nacidos desde hace más de 20 años o más recientemente, el VPH. Se trata de una plataforma que ha demostrado seguridad y que puede adaptarse fácilmente ante el surgimiento de nuevas variantes a nivel regional o mundial.
Además, esta vacuna podrá ser almacenada entre 2 y 8°C (temperatura de heladera), lo que permitirá que las dosis de la ARVAC Cecilia Grierson, a diferencia de las primeras vacunas contra el COVID-19, sean más económicas, fáciles de producir y de distribuir.